Besoins : la gestion du risque sur les dispositifs médicaux
Depuis sa création en 2008, Meddeva accompagne le développement de projets liés au domaine médical. La société offre une compétence pluridisciplinaire qui touche les dimensions techniques, cliniques et réglementaires. Elle propose sa propre approche sur l’externalisation de l’innovation dans le domaine des dispositifs médicaux (notamment les implants orthopédiques). L’objectif de Meddeva : accroître la performance et atteindre les objectifs de conformité de ses clients.
Si de nombreux logiciels dans le domaine existent et sont utilisés aujourd’hui par Meddeva, la société développe parfois ses propres solutions. C’est dans ce cadre que Meddeva travaille depuis 2009 en collaboration avec GLOBALIS sur la conception et la réalisation de plusieurs projets logiciels. Dernier en date : la mise en place d’un outil support pour la gestion des risques relatifs aux dispositifs médicaux.
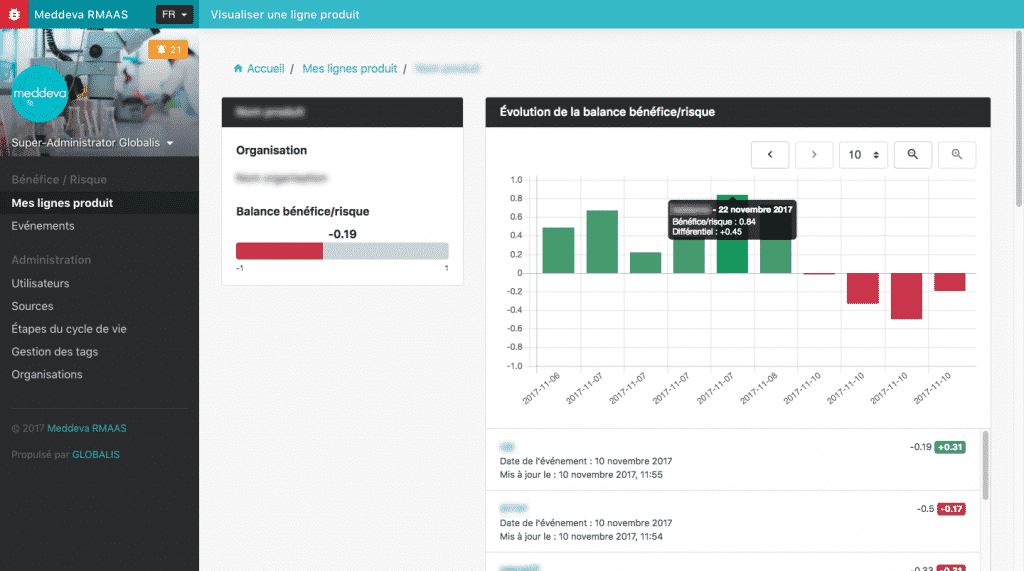
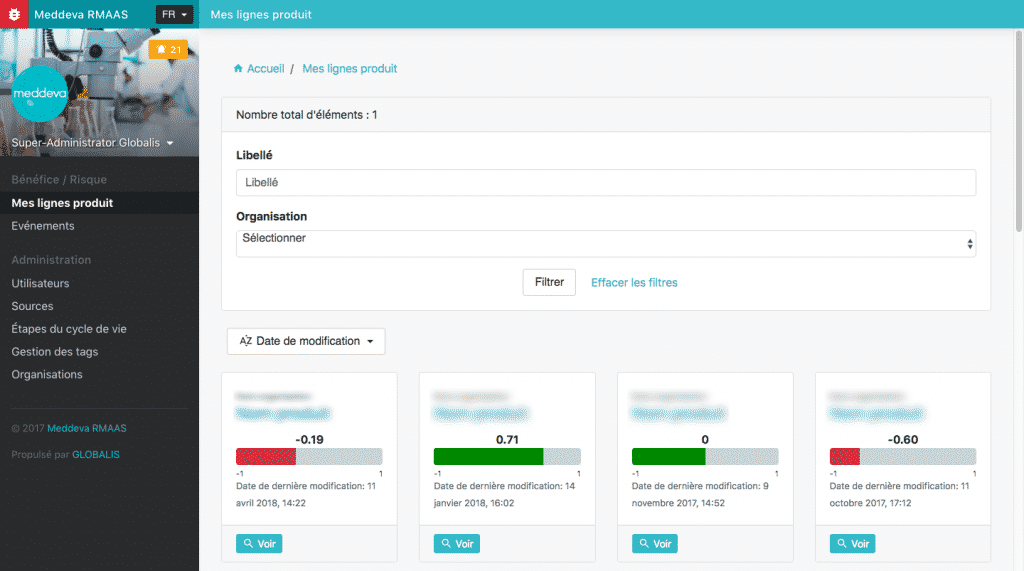
GLOBALIS a donc eu en charge l’élaboration de ce logiciel appelé RMAAS. Il permet de mettre à jour en temps réel la balance bénéfice/risque d’un produit en fonction d’événements saisis par l’utilisateur de l’application. Chacun de ces événements (publications, réclamations, données cliniques, etc) va ainsi accroître le risque ou augmenter le bénéfice du produit. L’objectif principal est de pouvoir anticiper au plus tôt les risques sur un produit pour prendre les mesures correctives et alerter le cas échéant.
Ce projet étant à destination du monde médical, traitant de gestion du risque et se basant sur des algorithmes de calcul complexe, les contraintes ont été logiquement très importantes. Que ce soit d’un point de vu technique ou législatif, GLOBALIS a su adapter sa méthode et ses outils pour répondre aux exigences de ce projet.
METHODOLOGIE : mise en place des TDD
La plus forte contrainte fut de rendre RMASS compatible avec le cadre de protection des enregistrements électroniques fixées par le code 21 CFR part 11. Émise par la FDA (Food & Drug Administration) en 1997, la réglementation finale 21 CFR Part 11 a été conçue pour permettre d’utiliser de manière la plus exhaustive possible la technologie électronique. Elle se compose de deux grandes sections distinctes : la gestion des données et la signature électronique.
Ces normes imposées dans le cadre de données médicales, notamment au USA (pays avec lequel travaille Meddeva), nous ont donné l’opportunité d’étoffer notre méthodologie, principalement sur la manière de développer et les tests applicatifs.
Pour cela, nous sommes partis sur un mode de développement basé sur la rédaction des tests avant tout développement technique. Cette méthode TDD (Test Driven Developpement) permet de décrire techniquement les résultats attendus en fonction de données en entrée. Concrètement, Meddeva nous fournissait les algorithmes de calculs et des résultats types, ces deux éléments nous servant de base pour notre processus de développement qui compte les 3 étapes suivantes :
- Etape 1 : coder les tests,
- Etape 2 : développer les algorithmes métier (par exemple pour le calcul du risque),
- Etape 3 : faire passer les algorithmes développés dans un outil des tests automatiques pour vérifier qu’ils répondent aux exigences des tests codés en étape 1.
Cette gestion très rigoureuse est plus coûteuse puisqu’elle nécessite une rigueur dans la rédaction des tests et doit couvrir tout le code source de l’application (hors librairies et base du framework). Cependant, elle était essentielle dans le cadre de ce projet qui met en jeu des données médicales et par extension des vies humaines.
Cette méthode nous a permis de répondre aux exigences du 21 CFR Part 11 en offrant une traçabilité et une validation automatique pour chaque modification du code source. Tout ceci nous permettant, entre autre, de justifier :
- que les développements répondent aux attentes d’un point de vue fonctionnel,
- que les nouvelles livraisons ne génèrent pas de régression technique ou fonctionnelle.
ENVIRONNEMENT ET CONTRAINTES TECHNIQUES
- LAMP : PHP7 et MySQL 5.7,
- i18n : internationalisation, le site est en anglais et en français et gère aussi les timezones des utilisateurs,
- CFR21 : norme du monde médical, ajoute de la sécurité et des logs sur l’ensemble des actions de utilisateurs,
- Tests automatisés : ces tests sont gérés via la librairie Codeception qui permet de faire de l’émulation navigateur en ligne commande OU de la simulation utilisateur à partir de scénario (ouvre automatiquement un navigateur et effectue des clics, des remplissages de champs, … Comme le ferait un utilisateur). Pour RMAAS, Codeception se base sur les outils Selenium et PHPUnit, dont il orchestre et synchronise le fonctionnement
RESULTATS
RMAAS a nécessité 160 jours de travail répartis sur 5 mois et 7 sprints de réalisation.
Le projet est en cours de déploiement (mars 2018) et suivra 2 phases. Une première permettant de mettre à disposition une version Beta auprès d’utilisateurs pilotes, puis une seconde qui ouvrira RMAAS a un public plus large.
Il ne s’agit que d’une première version d’une suite applicative plus large dont la suite devrait voir le jour entre 2018 et 2019.